Familia de sitios web de St. Jude
Explore nuestra investigación de avanzada, atención de pacientes de clase mundial, oportunidades de carrera y más.
Página de inicio del St. Jude Children’s Research Hospital
- Carreras

- Recaudación de fondos
-
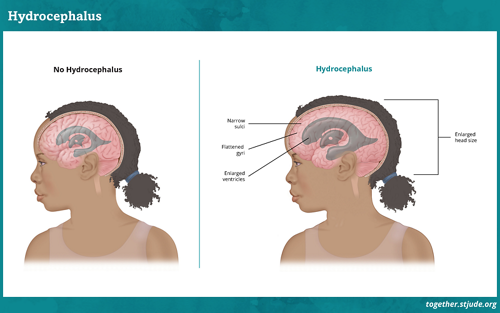
Cánceres infantiles
Explore información integral sobre el cáncer infantil y adolescente.
-
Trastornos de la sangre
Obtenga información sobre los tipos de trastornos de la sangre en niños y adolescentes.
-
Enfermedades infecciosas
Obtenga más información sobre las enfermedades infecciosas en niños y adolescentes.
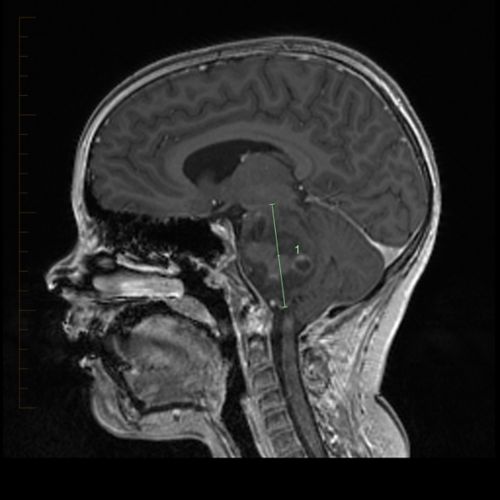
Tratamientos, pruebas y procedimientos
Obtenga información sobre los tratamientos, pruebas, procedimientos, medicamentos y efectos secundarios.
Obtenga información sobre la navegación y el manejo de la atención médica para niños y adolescentes.
- Equipo de Atención Médica Pediátrico
- Abordar la atención de la salud
- Atención en clínica y a domicilio
- Nutrición clínica
- Prevención y control de infecciones
- Manejo de medicamentos
- Riesgo hereditario y pruebas genéticas
- Psicología y servicios de salud mental
- Servicios de rehabilitación
- Cuidados paliativos (Cuidados de confort y apoyo)
- Etapa final de la vida
Obtenga información sobre el apoyo emocional y los recursos para ayudar con la vida cotidiana.
Obtenga más información sobre los videos, blogs, historias y otros recursos.