मेन्यू
बंद करना
एक्यूट माइलॉयड ल्यूकेमिया (एएमएल) खून और बोन मैरो में होने वाला एक कैंसर है। एएमएल एक्यूट लिम्फोब्लास्टिक ल्यूकेमिया (एएलएल) के बाद बचपन में होने वाला दूसरा सबसे आम खून का कैंसर है।
संयुक्त राज्य में प्रतिवर्ष लगभग 500 बच्चे एएमएल से पीड़ित पाए जाते हैं। यह वयस्कों में बहुत अधिक आम है।
बचपन में होने वाला एएमएल आमतौर पर जीवन के पहले 2 वर्षों के दौरान और किशोरावस्था वर्षों के दौरान सबसे अधिक पाया जाता है।
एएमएल माइलॉयड स्टेम सेल नामक रक्त कोशिकाओं को प्रभावित करता है। सामान्यतः, बोन मैरो (हड्डी के अंदर जहाँ खून बनता है) रक्त-उत्पादन करने वाली स्टेम सेल का निर्माण करती है जो या तो माइलॉयड स्टेम सेल या लिम्फॉइड स्टेम सेल बन जाते हैं। माइलॉयड स्टेम सेल निम्नलिखित तीन प्रकार में से एक प्रकार की परिपक्व रक्त कोशिका बन जाती है:
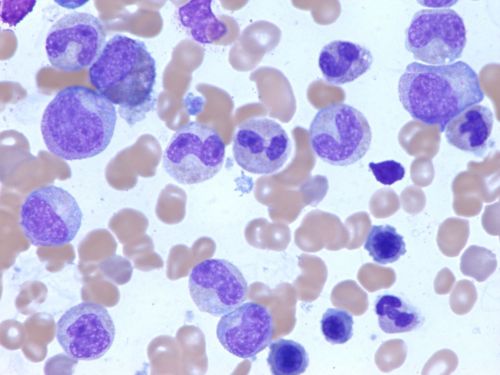
यह छवि दर्शाती है कि एक सामान्य, स्वस्थ बोन मैरो (हड्डी के अंदर जहाँ खून बनता है) माइक्रोस्कोप के माध्यम से कैसी दिखती है।
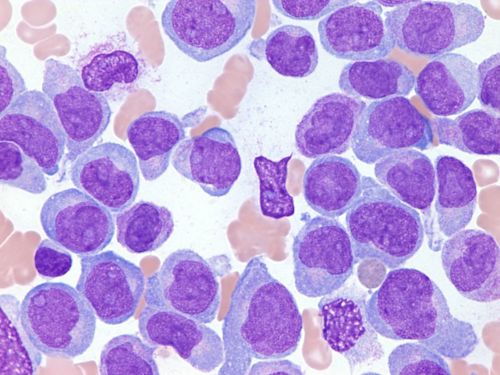
यह एक्यूट माइलॉयड ल्यूकेमिया से पीड़ित एक बाल रोगी की बोन मैरो (हड्डी के अंदर जहाँ खून बनता है) है।
खून के कैंसर (ल्यूकेमिया) में, कैंसर की कोशिकाएँ बोन मैरो में तेजी से बढ़ती हैं। ये कैंसर कोशिकाएँ अपरिपक्व सफेद रक्त कोशिकाएँ होती हैं जिन्हें ब्लास्ट कहा जाता है। जब ऐसा होता है, तो स्वस्थ रक्त कोशिकाएँ — सफेद रक्त कोशिकाएँ, लाल रक्त कोशिकाएँ और प्लेटलेट्स — अपना काम ठीक से नहीं कर पाती हैं।
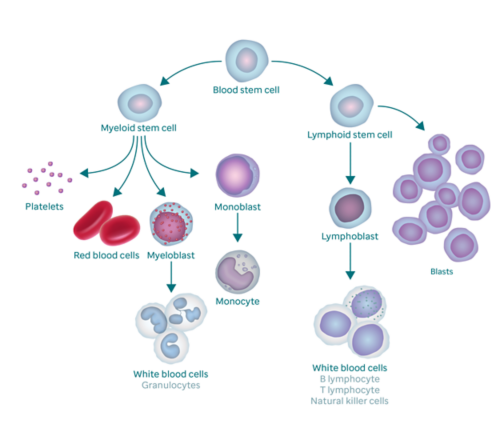
एएमएल माइलॉयड स्टेम सेल नामक रक्त कोशिकाओं को प्रभावित करता है। सामान्यतः, बोन मैरो (हड्डी के अंदर जहाँ खून बनता है) रक्त-उत्पादन करने वाली स्टेम सेल का निर्माण करती है जो या तो माइलॉयड स्टेम सेल या लिम्फॉइड स्टेम सेल बन जाते हैं।
एएमएल माइलॉयड स्टेम सेल नामक रक्त कोशिकाओं को प्रभावित करता है। सामान्यतः, बोन मैरो (हड्डी के अंदर जहाँ खून बनता है) रक्त-उत्पादन करने वाली स्टेम सेल का निर्माण करती है जो या तो माइलॉयड स्टेम सेल या लिम्फॉइड स्टेम सेल बन जाते हैं। माइलॉयड स्टेम सेल निम्नलिखित तीन प्रकार में से एक प्रकार की परिपक्व रक्त कोशिका बन जाती है:
बचपन में होने वाले एएमएल के जोखिम कारकों में निम्नलिखित शामिल हैं:
कुछ वंशानुगत विकार होना, जैसे:
एएमएल में, निम्नलिखित संकेत और लक्षण हो सकते हैं:
खून का कैंसर (ल्यूकेमिया) रोग की पहचान के लिए आमतौर पर बोन मैरो जाँच की आवश्यकता होती है। कई बार शारीरिक जांच करके, चिकित्सकीय इतिहास जान कर और खून की जाँच के परिणामों को देखने के बाद चिकित्सक ल्यूकेमिया (खून का कैंसर) की आशंका करने लगते हैं। खून के कैंसर (ल्यूकेमिया) से पीड़ित बच्चों के खून में आमतौर पर अपरिपक्व सफेद रक्त कोशिकाओं की संख्या बहुत अधिक होती है।
कैंसर का पता लग जाने पर, कैंसर के सही उपप्रकार का पता लगाने के लिए और अधिक जाँचें की जाएंगी। इन जाँचों में शामिल है:
कैंसर फैलने का पता लगाने के लिए कुछ जाँचें इस प्रकार हैं:
इलाज एएमएल के प्रकार पर निर्भर करता है। एएमएल के तीन प्रकार — एक्यूट प्रोमाइलोसाइटिक ल्युकेमिया (एपीएल), डाउन सिंड्रोम से ग्रस्त बच्चों में एएमएल, और FLT3-उत्परिवर्तित एएमएल — का इलाज एएमएल के अन्य प्रकारों की तुलना में अलग तरीके से किया जाता है।
कीमोथेरेपी एक प्राथमिक एएमएल इलाज है। बोन मैरो ट्रांसप्लांट भी एक विकल्प हो सकता है।
चिकित्सक इलाज की सूचना देने के लिए जानकारी एकत्र करते हैं।
रोगी में कीमोथेरेपी, तरल देने और उसके रक्त के नमूने लेने के लिए उसे टनल्ड सेंट्रल लाइन या अन्य सेंट्रल वेनस एक्सेस डिवाइस डालने की प्रक्रिया से गुजरना होगा।
इस चरण का लक्ष्य खून और बोन मैरो (हड्डी के अंदर जहाँ खून बनता है) में मौजूद खून के कैंसर वाली कोशिकाओं को नष्ट करना और रोगी को कैंसर-मुक्त करना है।
चूंकि एएमएल रोगी संक्रमण के प्रति अति संवेदनशील होते हैं, इसलिए उन्हें जीवाणु नाशक दवाई (एंटीबायोटिक) दवाओं के साथ सहायक इलाज भी दिया जाता है।
इस समय के दौरान, मस्तिष्क और रीढ़ के अंदर की नस में मौजूद खून के कैंसर की कोशिकाओं को नष्ट करने के लिए केंद्रीय तंत्रिका तंत्र (सीएनएस) सैंक्चुअरी थेरेपी भी दी जा सकती है (जिसे सीएनएस प्रोफिलैक्सिस भी कहा जाता है)।
चिकित्सक यह तय करने के लिए कि रोगी को हेमेटोपोएटिक कोशिका प्रत्यारोपण की आवश्यकता है या नहीं, संभवतः यह देखेंगे की इंडक्शन कीमोथेरेपी ने रोगी पर कितनी अच्छी तरह काम किया है। वास्तव में, यदि रोगी को प्रत्यारोपण की आवश्यकता पड़ती है तो ऐसे मामले में संभावित डोनर की पहचान करने के लिए रोगियों और परिवारों को एचएलए टाइपिंग की प्रक्रिया से गुजरना पड़ सकता है।
बहुत से बाल-चिकित्सा केंद्र न्यूनतम अवशिष्ट बीमारी (एमआरडी) को मापने के लिए अत्यधिक संवेदी जाँचों का उपयोग करते हैं। पॉज़िटिव एमआरडी इंगित करता है कि रोगी में रोग के वापस आने का अधिक खतरा है और उसे अधिक गहन थेरेपी की आवश्यकता है।
यह कन्सॉलिडेशन चरण रोगी के कैंसर-मुक्त होने के बाद शुरू होता है। इसका लक्ष्य शेष बची सभी खून का कैंसर (ल्यूकेमिया) कोशिकाओं को नष्ट करना होता है।
इसमें कीमोथेरेपी के 2-4 चक्र शामिल होते हैं।
कुछ रोगियों को इस स्तर पर हेमेटोपोएटिक कोशिका प्रत्यारोपण दिया जा सकता है। यदि रोगी का प्रत्यारोपण हुआ है, तो उसे कई सप्ताह तक अस्पताल में भर्ती रहना होगा। रोगी स्कूल वापस जा सके उससे पहले उसे ठीक होने में एक वर्ष तक का समय लग सकता है।
रोगी हर 4 महीने में एक बार फॉलो-अप विज़िट के लिए वापस आ सकता है।
इन दौरों में निम्नलिखित शामिल हो सकते हैं:
अनुवर्ती दौरे बदलकर हर 6 महीने में एक बार हो सकते हैं।
अनुवर्ती दौरे बदलकर साल में एक बार हो सकते हैं।
इस इंडक्शन चरण का लक्ष्य खून और बोन मैरो (हड्डी के अंदर जहाँ खून बनता है) में मौजूद खून के कैंसर वाली कोशिकाओं को नष्ट करना और रोगी को कैंसर-मुक्त करना है। चूंकि एएमएल रोगी संक्रमण के प्रति अति संवेदनशील होते हैं, इसलिए उन्हें जीवाणु नाशक दवाई (एंटीबायोटिक) दवाओं के साथ सहायक इलाज भी दिया जाता है।
इस समय के दौरान, मस्तिष्क और रीढ़ के अंदर की नस में मौजूद खून के कैंसर की कोशिकाओं को नष्ट करने के लिए केंद्रीय तंत्रिका तंत्र (सीएनएस) सैंक्चुअरी थेरेपी भी दी जा सकती है (जिसे सीएनएस प्रोफिलैक्सिस भी कहा जाता है)। दवाओं को इंजेक्शन से मस्तिष्क और रीढ़ के अंदर की नस (इंट्राथेकल) को कवर करने वाले ऊतक की पतली परतों के बीच तरल से भरे स्थान में डाला जाता है।
कैंसर के शुरूआती इलाज में आमतौर पर साइट्राबाइन और एक एन्थ्रासाइक्लिन जैसी दवाओं का संयोजन शामिल होता है, जो आमतौर पर डूनोरूबिसिन होता है। कैंसर के शुरूआती इलाज के दौरान इटॉप्साइड, थायोगुआनिन या जिम्टुज़ुमैब ओज़ोगामाइसिन भी दी जा सकती है।
इस चरण का लक्ष्य उन सभी शेष बची खून के कैंसर की कोशिकाओं को नष्ट करना है जो आगे विकसित होना शुरू हो सकती हैं और खून के कैंसर के रोग के वापस आने का कारण बन सकती हैं। कैंसर केंद्र ऐसी जाँचें कर सकते हैं जो 1,000 सामान्य कोशिकाओं में से एक एएमएल कोशिका का पता लगा सकते हैं। जिन बच्चों में इंडक्शन चरण को पूरा करने के बाद 1,000 में एक से अधिक कोशिकाएँ होती हैं, उनमें रोग के वापस आने का सबसे अधिक खतरा होता है।
यह कन्सॉलिडेशन चरण रोगी के कैंसर-मुक्त होने के बाद शुरू होता है। इसमें कीमोथेरेपी के 2-4 चक्र शामिल होते हैं और यह 4 से 6 महीने तक चलता है। इस तरह की चिकित्सा में नॉन-क्रॉस-प्रतिरोधी दवाओं और साधारणतः उच्च-खुराक साइट्राबाइन के समावेशन के साथ-साथ इंडक्शन में उपयोग की जाने वाली कुछ दवाएँ भी शामिल होती हैं।
हेमेटोपोएटिक सेल ट्रांसप्लांट (जिसे बोन मैरो ट्रांसप्लांट या स्टेम सेल ट्रांसप्लांट के रूप में भी जाना जाता है) की सलाह उन बच्चों के लिए दी जा सकती है जिनमें रोग के वापस आने का खतरा अधिक है या जिनके एएमएल पर इलाज का असर नहीं हो रहा है। चिकित्सक यह तय करने के लिए कि रोगी को बोन मैरो ट्रांसप्लांट की आवश्यकता है या नहीं, कभी-कभी यह देखते हैं कि इंडक्शन कीमोथेरेपी ने रोगी पर कितनी अच्छी तरह काम किया है।
एएमएल रोगियों में एलोजेनिक ट्रांसप्लांट किया जा सकता है।
एलोजेनिक बोन मैरो ट्रांसप्लांट में, बच्चों को एक स्वस्थ डोनर से रक्त कोशिका-उत्पादन करने वाली कोशिकाएँ दी जा सकती हैं। ट्रांसप्लांट का पात्र होने के लिए रोगियों के पास एक उपयुक्त डोनर होना आवश्यक है। डोनर कोशिकाओं को प्राप्त करने से पहले, रोगी में कीमोथेरेपी के द्वारा और कई बार रेडिएशन के द्वारा उनकी बोन मैरो (हड्डी के अंदर जहाँ खून बनता है) में मौजूद रक्त कोशिकाओं को नष्ट कर दिया जाता है। रोगी को निषेचन प्रक्रिया के माध्यम से रक्त और मैरो कोशिकाएँ दी जाती हैं। यदि यह प्रक्रिया सफल रहती है, तो शरीर में ये नई डोनर कोशिकाएँ आगे विकसित होंगी और रोगी की रक्त और मैरो कोशिकाओं की जगह ले लेंगी। परिणामस्वरूप, रोगी की बोन मैरो (हड्डी के अंदर जहाँ खून बनता है) को स्वस्थ रक्त कोशिकाएँ बनाना शुरू कर देना चाहिए।
बचपन में होने वाले एएमएल के लिए पांच साल की जीवित रहने की दर लगभग 70 प्रतिशत है।
एएमएल से पीड़ित लगभग 90 प्रतिशत बच्चों में आरंभिक इलाज के बाद उनके खून में कोई कैंसर कोशिका नहीं होती। एएमएल से पीड़ित लगभग 30 प्रतिशत बच्चों में रोग वापस आ जाता है या उनमें ऐसी बीमारी हो जाती है जो इलाज के प्रति प्रतिरोधक होती है (जिस पर प्रभाव न पड़े)।
कुछ एएमएल रोगियों में देर से दिखाई देने वाले प्रभाव हो सकते हैं। देरी से दिखाई देने वाला प्रभाव एक स्वास्थ्य-संबंधी समस्या है जो इलाज समाप्त होने के कई महीनों या वर्षों बाद दिखाई देती है।
कैंसर के इलाज के बाद कैंसर रोगियों को उनके उपचार केंद्र देखभाल टीम और/या समुदाय में प्राथमिक देखभाल चिकित्सक के निर्देशों का पालन करना चाहिए। देरी से दिखाई देने वाले प्रभावों का अक्सर इलाज किया जा सकता है या कुछ स्थितियों में उन्हें रोका जा सकता है।
अलग-अलग इलाजों के अलग-अलग देरी से दिखाई देने वाले प्रभाव हो सकते हैं। सभी रोगियों में देरी से दिखाई देने वाले प्रभाव नहीं होंगे। जिन रोगियों ने समान इलाज कराया था, वे अलग-अलग देरी से दिखाई देने वाले प्रभाव अनुभव कर सकते हैं।
एएमएल रोगियों को निम्न जोखिम हो सकता है:
हेमेटोपोएटिक सेल ट्रांसप्लांट से गुजरने वाले रोगियों को कुछ देरी से दिखाई देने वाले प्रभाव का जोखिम हो सकता है।
एएमएल के इलाज के लिए शोधकर्ता नई दवाओं का परीक्षण कर रहे हैं। इनमें शामिल है:
—
समीक्षा की गई: जून 2020