Меню
Закрывать
Острый миелолейкоз (ОМЛ) — это рак крови и костного мозга. ОМЛ является вторым наиболее распространенным детским лейкозом после острого лимфобластного лейкоза (ОЛЛ).
В США ежегодно регистрируется около 500 новых случаев заболевания у детей. Это заболевание гораздо чаще встречается у взрослых.
ОМЛ в детском возрасте чаще всего возникает в первые 2 года жизни и в подростковом возрасте.
ОМЛ поражает клетки крови, называемые миелоидными стволовыми клетками. Обычно костный мозг вырабатывает кроветворные стволовые клетки, которые затем становятся миелоидными стволовыми клетками или лимфоидными стволовыми клетками. Из миелоидной стволовой клетки возникает один из трех типов зрелых клеток крови.
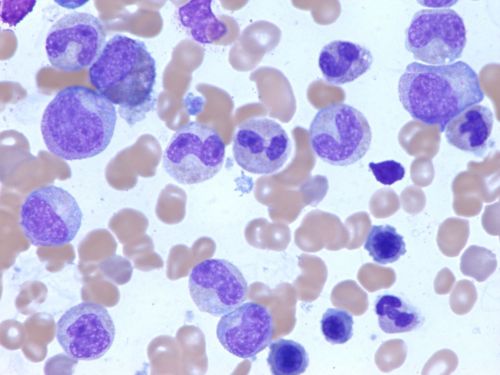
На этом изображении показано, как выглядит под микроскопом нормальный, здоровый костный мозг.
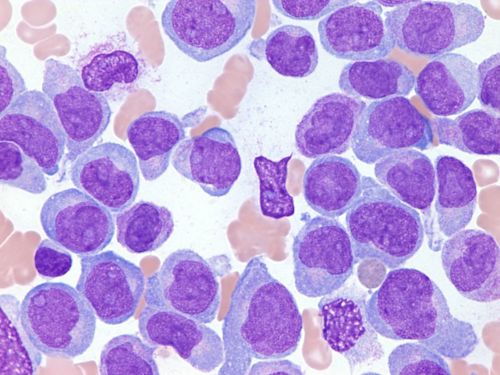
На этом изображении показан костный мозг ребенка с острым миелолейкозом.
При лейкозе опухолевые клетки в костном мозге быстро растут. Эти опухолевые клетки представляют собой незрелые белые клетки крови, называемые бластами. Когда это происходит, здоровые клетки крови — лейкоциты, эритроциты и тромбоциты — не могут правильно выполнять свои функции.
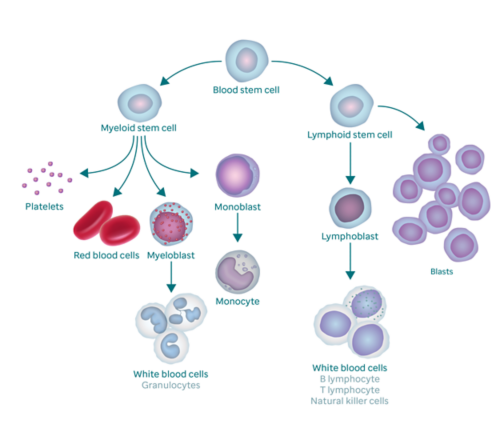
ОМЛ поражает клетки крови, называемые миелоидными стволовыми клетками. Обычно костный мозг вырабатывает кроветворные стволовые клетки, которые затем становятся миелоидными стволовыми клетками или лимфоидными стволовыми клетками.
ОМЛ поражает клетки крови, называемые миелоидными стволовыми клетками. Обычно костный мозг вырабатывает кроветворные стволовые клетки, которые затем становятся миелоидными стволовыми клетками или лимфоидными стволовыми клетками. Из миелоидной стволовой клетки возникает один из трех типов зрелых клеток крови.
Возможные факторы риска возникновения ОМЛ у детей:
Наличие определенных наследственных патологий:
Возможные признаки и симптомы ОМЛ указаны ниже.
Для диагностики лейкоза требуется провести исследование костного мозга. Подозрение на лейкоз может возникнуть после медицинского осмотра, изучения истории болезни и оценки результатов анализа крови. У детей с лейкозом обычно имеется большое количество незрелых белых клеток крови.
После подтверждения диагноза врачи проведут дополнительные анализы, чтобы точно определить вид лейкоза. Используют такие исследования:
Чтобы определить распространение опухоли, используют такие исследования:
Лечение зависит от типа ОМЛ. Лечение трех форм ОМЛ — острого промиелоцитарного лейкоза (ОПМЛ), ОМЛ у детей с синдромом Дауна и ОМЛ с мутацией FLT3 — проводят иначе, чем лечение других форм ОМЛ.
Основным методом лечения ОМЛ является химиотерапия. Трансплантация костного мозга также может быть вариантом терапии.
Врачи собирают информацию для выбора методов лечения.
Пациенту устанавливаюттоннельный центральный катетер или другой центральный венозный катетер для химиотерапии, введения жидкостей и взятия образцов крови.
Целью данной фазы является уничтожение бластных клеток в крови и костном мозге и перевод заболевания в ремиссию.
Поскольку пациенты с ОМЛ уязвимы для инфекции, также назначают поддерживающую терапию антибиотиками.
В это же время для уничтожения лейкозных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС).
Иногда врачи оценивают эффективность индукционной химиотерапии, чтобы решить, требуется ли трансплантация гемопоэтических клеток. Фактически, если пациенту необходимо пройти трансплантацию, пациенты и их семьи могут проходить HLA-типирование для выявления возможных доноров.
Во многих детских медицинских центрах используются высокочувствительные тесты для измерения минимальной остаточной болезни (МОБ). Положительная МОБ указывает на более высокий риск рецидива и необходимость применения более интенсивной терапии.
Эта фаза консолидации начинается после наступления у пациента ремиссии. Ее целью является уничтожение любых лейкозных клеток, которые могут остаться после предыдущих фаз.
Она включает 2–4 цикла химиотерапии.
На этой стадии для некоторых пациентов может выполняться трансплантация гемопоэтических клеток. Если пациенту провели трансплантацию, он подлежит госпитализации на несколько недель. Скорее всего, в школу ребенок сможет вернуться только через год.
Пациент может посещать врача в рамках последующего наблюдения один раз в 4 месяца.
Во время проверок проводятся такие обследования:
Частота визитов для последующего наблюдения может быть снижена до одного раза в 6 месяцев.
Частота визитов для последующего наблюдения может быть снижена до одного раза в год.
Целью фазы индукции является уничтожение бластных клеток в крови и костном мозге и перевод заболевания в ремиссию. Поскольку пациенты с ОМЛ уязвимы для инфекции, также назначают поддерживающую терапию антибиотиками.
В это же время для уничтожения лейкозных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). Лекарственные препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими головной и спинной мозг (интратекально).
Индукционная терапия обычно включает в себя комбинацию таких препаратов, как цитарабин и антрациклиновый препарат, чаще всего даунорубицин. Во время индукционной терапии также могут назначаться этопозид, тиогуанин или гемтузумаб озогамицин.
Целью этой фазы является уничтожение любых оставшихся бластных клеток, которые могут расти и привести к рецидиву заболевания. В онкологических центрах есть возможность выполнять тесты, которые позволяют обнаружить одну клетку ОМЛ среди 1000 нормальных клеток. Дети, у которых обнаруживается более 1 клетки на 1000 после завершения фазы индукции, подвержены наивысшему риску рецидива.
Эта фаза консолидации начинается после наступления у пациента ремиссии. Она включает 2–4 цикла химиотерапии и длится от 4 до 6 месяцев. В ходе такой терапии применяются некоторые лекарственные препараты, используемые во время фазы индукции, а также введение не кросс-резистентных препаратов и обычно высоких доз цитарабина.
Трансплантация гемопоэтических клеток (также называемая трансплантацией костного мозга или стволовых клеток) может быть рекомендована детям с высоким риском рецидива или с резистентным к лечению ОМЛ. Иногда врачи оценивают эффективность индукционной химиотерапии, чтобы решить, требуется ли трансплантация костного мозга.
Пациентам с ОМЛ могут назначить аллогенную трансплантацию.
При аллогенной трансплантации костного мозга дети получают гемопоэтические клетки, вырабатывающие кровяные тельца, от здорового донора. Для этого необходимо найти подходящего донора. До получения донорских клеток необходимо уничтожить собственные клетки крови в костном мозге пациента, для чего применяется химиотерапия и — в некоторых случаях — облучение. Во время трансплантации пациенту вводят здоровые донорские клетки крови и костного мозга посредством инфузии. В случае успеха эти новые донорские клетки будут расти и замещать клетки крови и костного мозга пациента. В результате в костном мозге пациента должны начать вырабатываться здоровые клетки крови.
Для детей с ОМЛ 5-летняя выживаемость составляет около 70%.
Примерно у 90% детей с ОМЛ после первоначального лечения опухолевые клетки в крови отсутствуют. Примерно у 30% детей с ОМЛ происходит рецидив или заболевание оказывается устойчивым к лечению (рефрактерным).
У некоторых пациентов с ОМЛ могут наблюдаться отдаленные последствия. Отдаленное последствие — это проблема со здоровьем, возникающая спустя месяцы или годы после окончания лечения.
После окончания лечения пациенты с онкологическими заболеваниями должны оставаться под наблюдением лечащей бригады медицинского центра, в котором они проходили лечение, и/или лечащего врача в поликлинике по месту жительства. Отдаленные последствия зачастую поддаются лечению или, в некоторых случаях, их возникновение можно предотвратить.
Различные методы лечения могут привести к разным отдаленным последствиям. Отдаленные последствия возникают не у всех пациентов. У пациентов, которые получали одинаковое лечение, могут наблюдаться разные отдаленные последствия.
Пациенты с ОМЛ подвержены следующим рискам:
У пациентов, подвергшихся трансплантации гемопоэтических клеток, могут возникнуть определенные виды отдаленных последствий.
В настоящее время ученые исследуют новые препараты для лечения ОМЛ. К ним относятся:
—
Дата изменения: Июнь 2020 г.