मेन्यू
बंद करना
आमतौर पर बोन मैरो ट्रांसप्लांट, स्टेम सेल ट्रांसप्लांट या hsct के रूप में जाना जाता है
हेमटोपोइएटिक सेल ट्रांसप्लांट एक चिकित्सा प्रक्रिया है जिसका उपयोग बचपन में होने वाले कैंसर सहित कई प्रकार की बीमारियों के इलाज के लिए किया जाता है। यह क्षतिग्रस्त या खराब खून बनाने वाली (हेमटोपोइएटिक) कोशिकाओं को स्वस्थ खून बनाने वाली कोशिकाओं के साथ प्रतिस्थापित करता है।
चूंकि खून बनाने वाली कोशिकाओं का मुख्य स्रोत बोन मैरो है, इसलिए प्रक्रिया को पारंपरिक रूप से बोन मैरो ट्रांसप्लांट कहते हैं। धीरे-धीरे इस क्षेत्र में विकास के साथ-साथ इसे हेमेटोपोएटिक सेल ट्रांसप्लांट कहा जाना लोकप्रिय हो गया। इन शब्दों को अक्सर एक-दूसरे के स्थान पर उपयोग किया जाता है। कुछ लोग इस प्रक्रिया को स्टेम सेल ट्रांसप्लांट भी कह सकते हैं।
प्रत्यारोपण से बचपन में होने वाले कुछ कैंसर का सफलतापूर्वक इलाज किया जा सकता है, लेकिन इसके गंभीर दुष्प्रभाव और देरी से प्रभाव हो सकते हैं। इस विकल्प पर ध्यान से विचार करना चाहिए। प्रत्यारोपण करवाना कोई आसान प्रक्रिया नहीं है। यह रोगी और परिवार के देखभालकर्ता, दोनों पर शारीरिक और मानसिक रूप से प्रभाव डाल सकता है। लेकिन इस दौरान रोगियों और परिवारों की सहायता करने के लिए प्रत्यारोपण देखभाल टीम के कई लोग मौजूद रहेंगे। कई बच्चे और किशोर जिनके प्रत्यारोपण हो चुके हैं, वे अब सक्रिय कैंसर मुक्त जीवन जी रहे हैं।
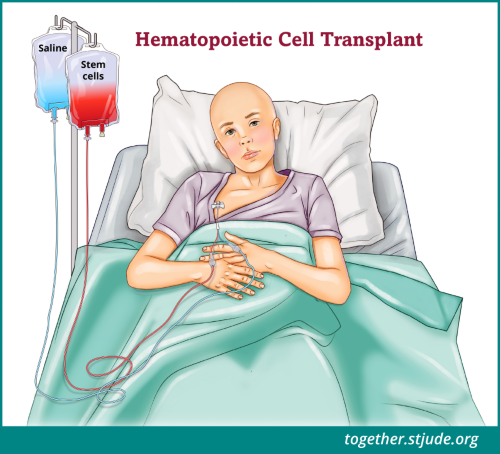
प्रत्यारोपण के दो मूल प्रकार हैं: एलोजेनिक (खून बनाने वाली कोशिकाएं किसी दान देने वाले से ली जाती हैं) और ऑटोलॉगस (रोगी की स्वयं की कोशिकाओं का उपयोग किया जाता है)। रोगी ब्लड ट्रांसफ़्यूजन की तरह नस के माध्यम से दाता से कोशिकाएं लेता है। कोशिकाएं ब्लड स्ट्रीम से होकर लंबी हड्डियों के केंद्र तक जाती हैं। ट्रांसप्लांट की गई कोशिकाओं की मदद से रोगी, स्वस्थ लाल रक्त कोशिकाओं, सफेद रक्त कोशिकाओं और प्लेटलेट्स को बनाता है।
बोन मैरो शरीर की अधिकांश हड्डियों के केंद्र में एक नरम, स्पंज जैसी सामग्री होता है। बड़ी संख्या में खून बनाने वाली (हेमटोपोइएटिक) कोशिकाएं बोनमैरो में रहती हैं।
हेमटोपोइएटिक कोशिकाएं अन्य सभी रक्त कोशिकाओं की जनक हैं। परिपक्व होकर ये कोशिकाएं बनती हैं और आगे चलकर ये निम्नलिखित बनती हैं:
बोनमैरो, रक्त कोशिका के कारखाने की तरह काम करता है, लगातार नई हेमटोपोइएटिक कोशिकाएं बनाता है ताकि खून में लाल रक्त कोशिकाएं, सफेद रक्त कोशिकाएं और प्लेटलेट्स अच्छे से अपना काम कर सकें।
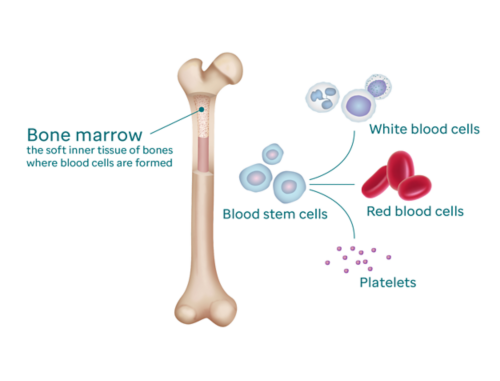
सभी लाल रक्त कोशिकाएं और प्लेटलेट्स साथ ही लगभग 70 प्रतिशत सफेद रक्त कोशिकाएं, बोन मैरो में बनती हैं। (अन्य 30 प्रतिशत तिल्ली / प्लीहा, लसिका ग्रंथि और बाल्यग्रन्थि से बनती हैं।)
हेमटोपोइएटिक कोशिकाओं की बहुत कम संख्या पेरिफ़ेरल (परिसंचारी) खून में पाई जा सकती है। गर्भनाल रक्त भी खून बनाने वाली कोशिकाओं का एक स्रोत है।
प्रत्यारोपण का लक्ष्य निम्नलिखित है:
बचपन में होने वाले कैंसर में, प्रत्यारोपण मुख्य रूप से ल्यूकेमिया (खून का कैंसर) के इलाज के लिए किया जाता है, आमतौर पर जब कैंसर के लिए मानक इलाज विफल हो जाता है। खून और बोन मैरो का कैंसर ल्यूकेमिया से शरीर में क्षतिग्रस्त सफेद रक्त कोशिकाओं का उत्पादन होने लगता है, जिससे रोगी बहुत बीमार हो जाता है।
प्रत्यारोपण कभी-कभी अन्य कैंसर के इलाज के लिए भी किया जाता है। उदाहरण के लिए न्यूरोब्लास्टोमा, मल्टीपल मायलोमा, आवर्तक ईविंग सारकोमा और आवर्तक विल्म्स ट्यूमर।
कैंसर के ऐसे रोगियों के इलाज के लिए भी प्रत्यारोपण का उपयोग किया जा सकता है जिसमें नरम ऊतक या मस्तिष्क के ट्यूमर शामिल होते हैं, जिनकी बीमारी का इलाज करने के लिए कीमोथेरेपी या रेडिएशन की बहुत अधिक खुराक की आवश्यकता होती है।
प्रत्यारोपण दो प्रकार के होते हैं:
प्रत्यारोपण एक शारीरिक रूप से चुनौतीपूर्ण चिकित्सा प्रक्रिया है। सबसे पहले चिकित्सीय टीम यह देखेगी कि क्या रोगी प्रत्यारोपण के लिए सक्षम है। इसके लिए टीम रोगी की इन चीजों पर गौर करेगी:
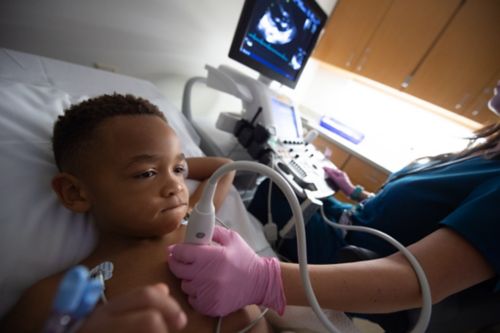
दिल के काम करने की स्थिति को मापने के लिए एक इकोकार्डियोग्राम (इको) जैसे हृदय परीक्षण का उपयोग किया जा सकता है।
यह सुनिश्चित करने के लिए कि रोगी प्रत्यारोपण को सहन कर सकता है, उसके दिल, फेफड़े, गुर्दे और अन्य महत्वपूर्ण अंगों पर परीक्षण होंगे। इन जांचों में शामिल हैं:
अगर पहले उनका परीक्षण नहीं हुआ है, तो रोगी को एक केंद्रीय लाइन लगाई जाएगी, ताकि उन्हें बार-बार सुई न लगानी पड़े।
रोगी परिवार, भावनात्मक स्वास्थ्य पर चर्चा करने के लिए एक सामाजिक कार्यकर्ता या मनोवैज्ञानिक से भी मिलेंगे। साथ ही, बीमा की रकम मिलने और वित्तीय मुद्दों में मदद पाने के लिए वित्तीय परामर्शदाता से भी मिलेंगे।
अस्पताल की प्रत्यारोपण टीम दाता खोजने में मदद करेगी। सगे भाई-बहन पहले विकल्प होते हैं क्योंकि दाता और रोगी के हेमटोपोइएटिक कोशिकाओं में समान आनुवंशिक मार्कर होने चाहिए। ये मार्कर प्रोटीन हैं जिन्हें मानवीय ल्यूकोसाइट एंटीजन (एचएलए) कहा जाता है। यह निर्धारित करना कि कोई एचएलए मैच है या नहीं, उसे एचएलए परीक्षण की आवश्यकता होती है, जिसमें रोगी और संभावित दाता के खून का नमूना लिया जाता है। कुछ मामलों में, इस परीक्षण के लिए एक आंतरिक गाल के स्वैब के नमूना का उपयोग किया जा सकता है। कोशिकाओं को परीक्षण के लिए एक प्रयोगशाला में भेजा जाता है।
चूंकि ये आनुवंशिक मार्कर माता-पिता से विरासत में मिलते हैं, इसलिए भाई या बहन के मैच होने की संभावना सबसे अधिक होती है। अगर रोगी और भाई-बहन के जैविक माता-पिता समान हैं, तो प्रत्येक भाई और बहन से रोगी को एचएलए मैच होने की 25 प्रतिशत संभावना होती है। इस वजह से, लगभग 70% रोगियों को मैच भाई-बहन नहीं मिलते।
अगर भाई-बहन मैच नहीं होते, तो देखभाल टीम नेशनल डोनर मैरो प्रोग्राम के Be the Match® रजिस्ट्री के माध्यम से दाता या कॉर्ड ब्लड यूनिट (अगर प्रत्यारोपण सेंटर कॉर्ड ब्लड प्रत्यारोपण करती है) खोजेगी। लगभग 30 प्रतिशत रोगियों को असंबंधित दाता के मैच मिलते हैं।
अगर पूरा सही मैच नहीं मिल सकता है, तो चिकित्सक एक बेमेल दाता का उपयोग करने का सुझाव दे सकता है, जो ऐसा दाता होगा जो पूरी तरह मैच नहीं होगा, लेकिन उसका एचएलए कुछ हद तक मैच होगा। बेमेल दाता प्रत्यारोपण काफी सामान्य हैं, और कई इसमें सफल हैं।
उन रोगियों के लिए जो एक उपयुक्त दाता नहीं पा सकते हैं, कुछ मामलों में “आधा मैच” वाले परिवार के सदस्य के बोन मैरो या पेरिफ़ेरल हेमटोपोइएटिक कोशिकाओं का उपयोग करना संभव है। इस तरह के प्रत्यारोपण को हापलॉआइडेंटिकल (आधा-मैच) बोन मैरो ट्रांसप्लांट कहा जाता है।
दाताओं को दाता बनाने के लिए चिकित्सकीय रूप से सक्षम होना चाहिए। दाता केंद्र, Be the Match के माध्यम से, संभावित दाता की कुछ स्वास्थ्य स्थितियों की जांच करेगा:
खून बनाने वाली कोशिकाओं को बोन मैरो, सतही (परिसंचारी) खून से और दान किए गए गर्भनाल के खून से एकत्र किया जा सकता है। इस प्रक्रिया को स्टेम सेल प्राप्त करना कहा जाता है।
कई रोगियों को लगता है कि प्रत्यारोपण एक जटिल सर्जिकल प्रक्रिया है, लेकिन प्रत्यारोपण बहुत ही आसान प्रक्रिया है। यह काफी हद तक खून देने जैसा होता है। दाता के सेल एक बैग या सिरिंज में होते हैं जो एक ट्यूब के माध्यम से रोगी की केंद्रीय लाइन से जुड़ा होता है। इसमें कुछ मिनट से कुछ घंटे ही लगते हैं और यह दर्दनाक नहीं होता है।
खून में प्रवेश करने के बाद, हेमटोपोइएटिक कोशिकाएं, बोन मैरो तक जाती हैं, जहां वे विभाजित होने लगती हैं और उत्कीर्णन प्रक्रिया के तहत सफेद रक्त कोशिकाएं, लाल रक्त कोशिकाएं और प्लेटलेट्स बन जाती हैं। जुड़ाव आमतौर पर 2-4 सप्ताह में होता है (लंबे समय तक अगर स्रोत एक गर्भनाल था।) ऑटोलॉगस (रोगी की स्वयं की कोशिकाओं का उपयोग) प्रत्यारोपण में प्रतिरक्षा प्रणाली को पूरी तरह सही होने में 6 महीने लग सकते हैं या अगर एलोजेनिक (संबंधित या असंबंधित दाता कोशिकाओं का उपयोग करके) प्रत्यारोपण है, तो एक साल लग सकता है।
चिकित्सक विभिन्न खून की जाँचों के परिणामों का मूल्यांकन करते हैं, ताकि यह पुष्टि की जा सके कि नई रक्त कोशिकाओं का उत्पादन (वृद्धि) हो रहा है और कैंसर वापस नहीं आया है। प्रत्यारोपण के बाद, हर दिन रोगियों का खून लिया जाता है और लैब में इसका परीक्षण किया जाता है। चिकित्सक गिनेंगे कि शरीर में कितनी लाल रक्त कोशिकाएं, सफेद रक्त कोशिकाएं और प्लेटलेट्स हैं। चूंकि ये हर दिन गिने जाते हैं, तो चिकित्सक और रोगी प्रगति का ट्रैक रख सकते हैं। क्योंकि हर कोई अलग है, इसलिए रक्त कोशिकाओं का उत्पादन अलग-अलग समय पर हो सकता है। आमतौर पर इसमें दो सप्ताह से एक महीने तक लगता है। सफ़ेद रक्त कोशिकाएं सबसे पहले बनना शुरू होने वाली होती हैं, इसके बाद लाल रक्त कोशिकाएं और फिर प्लेटलेट्स। रोगी को लाल रक्त कोशिकाओं और प्लेटलेट्स के ट्रांसफ़्यूजन की आवश्यकता हो सकती है, ताकि जब वे इनके बनने का इंतज़ार करें, तब तक गिनती सही रहे।
बोन मैरो एस्पिरेशन (माइक्रोस्कोप से जांच के लिए एक सुई के माध्यम से बोनमैरो के एक छोटे से नमूने को निकालना) भी चिकित्सकों को यह निर्धारित करने में मदद कर सकता है कि नई खून बनाने वाली कोशिकाएं कितनी अच्छी तरह काम कर रही हैं और कहीं कैंसर वापस तो नहीं आ रहा।
रोगी के प्रत्यारोपण इकाई से जाने के बाद भी उनकी प्रतिरक्षा प्रणाली कमजोर रहती है और उन्हें संक्रमण से लड़ने में कठिनाई होगी। इनमें से कुछ संक्रमण जानलेवा हो सकते हैं। छुट्टी के बाद, रोगियों को उनके साथ घर पर देखभालकर्ता की आवश्यकता होगी जब तक कि उनकी प्रतिरक्षा प्रणाली सामान्य न हो जाए। इसमें कुछ महीनों से एक वर्ष तक का समय लग सकता है।
अगर रोगी का मुख्य देखभाल करने वाला बदलता है, तो तुरंत प्रत्यारोपण क्लिनिक स्टाफ़ को बताएं। पहले से बदलाव की योजना बनाना अच्छा है। प्रत्यारोपण स्टाफ़ सदस्य को हर देखभालकर्ता को प्रशिक्षित करना होगा।
सबसे गंभीर दुष्प्रभाव और देर से दिखाई देने वाले प्रभाव का कारण बनने वाली दो स्थितियां हैं ग्राफ़्ट रिजेक्शन और ग्राफ़्ट बनाम होस्ट रोग (जीवीएचडी)।
देखभालकर्ता को रोगी के स्थानीय चिकित्सक या उनकी प्रत्यारोपण इकाई के चिकित्सक या नर्स प्रैक्टिशनर को तुरंत कॉल करना चाहिए, अगर रोगी में निम्न में से एक या अधिक लक्षण दिखाई देते हैं:
शारीरिक दुष्प्रभावों और परिवार, दोस्तों और सामान्य दिनचर्या से अलग होने के कारण, रोगियों में उदासी या अवसाद हो सकता है। एक या दो दिन उदास महसूस करना ठीक है, लेकिन अगर ये भावनाएं लंबे समय तक रहती हैं तो रोगियों को अपनी देखभाल टीम के सदस्य से बात करनी चाहिए। यह उनके चिकित्सक या नर्स या शायद उनके सामाजिक कार्यकर्ता, चैपलिन (पादरी), मनोविज्ञानी (साइकोलॉजिस्ट) या शिशु जीवन विशेषज्ञ हो सकते हैं।
प्रत्यारोपण से जुड़ी कुछ समस्याओं को देरी से प्रभाव के रूप में जाना जाता है, क्योंकि वे इलाज के कई महीनों या वर्षों बाद तक स्पष्ट नहीं होती हैं। उनमें से अधिकांश समय के साथ सही हो जाती हैं, लेकिन अन्य स्थायी हो सकती हैं और उनपर लंबे समय तक ध्यान देना पड़ता है।
प्रत्यारोपण के देरी से दिखाई देने वाले प्रभाव में ये शामिल हो सकते हैं:
कोई भी इन सभी समस्याओं का अनुभव नहीं करता है। प्रत्यारोपण के बाद समस्याओं के विकास का जोखिम इस बात पर निर्भर करेगा कि आपकी बीमारी कौनसी है, आपका प्रत्यारोपण कैसा था, आपकी उम्र क्या है और पूर्व इलाज का इतिहास क्या है। उचित स्क्रीनिंग और निवारक उपायों के साथ कई जटिलताओं को रोका जा सकता है। नियमित तौर पर चिकित्सक से मिलना बहुत महत्वपूर्ण है।
दुष्प्रभाव मौजूद हैं या नहीं यह निर्धारित करने के लिए प्रत्यारोपण के बाद लंबे समय तक रोगियों की जांच की जाती है। प्रत्यारोपण के लिए तैयार होने के लिए जिन रोगियों के पूरे शरीर में रेडिएशन हुआ था उनमें अंतःस्रावी या एंडोक्राइन (ग्रंथि) समस्याओं का खतरा होता है जैसे, हाइपोपैरैथायराइडिज्म, एड्रिनल अपर्याप्तता या वृद्धि हार्मोन अपर्याप्तता। यह महत्वपूर्ण है कि रोगी की ऊंचाई और वजन नियमित रूप से दर्ज किया जाए और अगर आवश्यक हो, तो किसी एंडोक्राइन विशेषज्ञ की निगरानी में रहें।
कुछ मामलों में, प्रत्यारोपण के बाद कैंसर वापस (रिलैप्स) आ सकता है। प्रत्यारोपण के बाद पहले साल में रिलैप्स सबसे आम है और जैसे-जैसे समय बीतता है जोखिम कम होता जाता है। प्रत्यारोपण टीम आपकी देखभाल करना जारी रखेगी और अन्य इलाज विकल्पों पर चर्चा करेगी। इनमें बीमारी का परीक्षण या कोई अन्य प्रत्यारोपण शामिल हो सकता है।
—
समीक्षा की गई: जून 2018