Меню
Закрывать
Острый лимфобластный лейкоз (ОЛЛ) — это злокачественное заболевание крови и костного мозга. При лейкозе здоровые клетки крови замещаются опухолевыми клетками, что может стать причиной жара, повышенной утомляемости, синяков, проблем со свертыванием крови, инфекций и других нарушений. Обычно при остром лейкозе симптомы усиливаются в течение короткого периода. У детей болезнь может развиваться очень быстро и требует незамедлительного лечения.
ОЛЛ нарушает процесс созревания белых клеток крови, называемых лимфоцитами. Эти клетки борются с инфекциями и обеспечивают защиту организма от заболеваний. В костном мозге пациентов с ОЛЛ содержится слишком много незрелых белых кровяных клеток (бластов). Такие клетки не способны полноценно функционировать. Они замещают собой нормальные белые и красные кровяные тельца, а также тромбоциты. В результате организму становится сложнее бороться с инфекциями, кожа становится бледной, возникают проблемы со свертыванием крови.
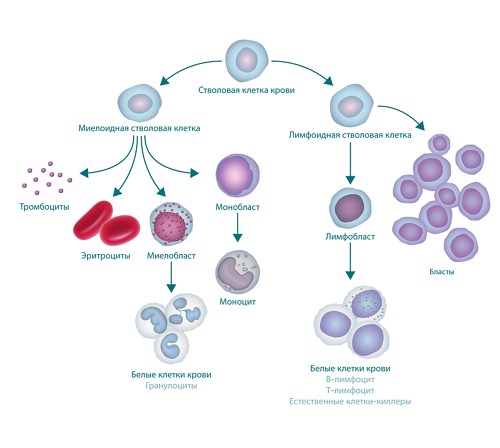
ОЛЛ нарушает процесс созревания разновидности белых клеток крови, называемой лимфоцитами. В костном мозге пациентов с ОЛЛ содержится слишком много незрелых белых клеток крови (бластов). Такие клетки не способны полноценно функционировать. Они замещают собой нормальные лейкоциты, эритроциты и тромбоциты.
ОЛЛ является наиболее распространенным онкологическим заболеванием у детей В США ОЛЛ ежегодно диагностируется у порядка 3000 человек моложе 20 лет. Чаще всего заболевание развивается у детей в возрасте от 2 до 5 лет, но также встречается и у детей старшего возраста и подростков. У мальчиков оно возникает несколько чаще, чем у девочек.
Возможные признаки и симптомы ОЛЛ:
При обнаружении опухолевого процесса проводят дополнительные анализы для точного определения вида заболевания. Используют такие исследования:
Исследования, определяющие степень распространения заболевания:
Основным методом лечения для детей с ОЛЛ является химиотерапия. Лечение также может включать в себя таргетную терапию, терапию с использованием гемопоэтических клеток (также называемую трансплантацией костного мозга или стволовых клеток), иммунотерапию и лучевую терапию.
Благодаря недавним достижениям в лечении ОЛЛ существует много различных вариантов лечения. Врачи все чаще могут адаптировать лечение для отдельных пациентов в зависимости от их группы риска.
Группа риска означает вероятность того, что опухоль пациента не будет поддаваться лечению (резистентная опухоль), либо заболевание вернется после первоначальной реакции на лечение (рецидив). Пациентам в группах низкого риска обычно проводят менее интенсивную терапию, которая тем не менее успешно справляетсяс опухолью.. Для пациентов в группах высокого риска обычно применяют более агрессивные методы лечения.
Группу риска определяют следующие факторы:
Врачи собирают информацию для выбора методов лечения.
Пациенту проведут хирургическую операцию для установки подкожной порт-системы илидругого устройства венозного доступадля химиотерапии, введения жидкостей и взятия образцов крови.
Целью данной фазы является использование комбинации химиотерапевтических препаратов для уничтожения опухолевых клеток в крови и костном мозге и перевода заболевания в ремиссию. Это фаза интенсивного лечения, и для нее может потребоваться пребывание пациента в стационаре.
Для уничтожения опухолевых клеток в спинномозговой жидкости может быть назначена сохраняющая терапия центральной нервной системы (ЦНС).
Врачи будут наблюдать за реакцией лейкоза на индукционную терапию, чтобы определить, каким образом продолжить лечение.
Целью этой более интенсивной фазы является использование другой комбинации препаратов для уничтожения любых оставшихся клеток, способных вызвать рецидив лейкоза. На это время может потребоваться пребывание пациента в стационаре.
Пациентам с ОЛЛ, положительным по филадельфийской хромосоме, на этой фазе могут назначать иматиниб.
Еслипосле этих двух стадий лечения ремиссия сохраняется, можно начинать поддерживающую терапию. Ее целью является использование комбинации химиотерапевтических препаратов для уничтожения любых опухолевых клеток, которые могут остаться после первых фаз индукции и консолидации.
В это время еженедельная химиотерапия и анализы крови обычно чередуются с периодами высокодозной химиотерапии — реиндукцией.
Первые 9 месяцев лечения ОЛЛ обычно являются наиболее интенсивными. Часто пациенты могут вернуться в школу после первых 9 месяцев.
Пациент будет посещать врача в рамках последующего наблюдения один раз в 4 месяца.
Во время проверок проводятся такие обследования:
Частота визитов для последующего наблюдения может быть снижена до одного раза в 6 месяцев.
Частота визитов для последующего наблюдения может быть снижена до одного раза в год.
Лечение ОЛЛ включает в себя 3 фазы и длится от 2 до 3 лет. Основным методом лечения ОЛЛ является химиотерапия. В химиотерапии используются мощные лекарственные препараты для остановки роста опухолевых клеток, уничтожая их или препятствуя их делению. Детям чаще всего назначают комбинацию различных лекарственных препаратов. Эти препараты могут вводиться в кровоток (внутривенно), приниматься внутрь (перорально) или же вводиться непосредственно в спинномозговую жидкость (интратекально).
Выбор метода химиотерапии и лекарственных средств зависит от группы риска ребенка. Дети с лейкозом высокого риска обычно получают больше противоопухолевых препаратов и/или более высокие дозы, чем дети с ОЛЛ низкого риска.
1. Индукция
Целью индукционной терапии является уничтожение бластных клеток в крови и костном мозге и перевод заболевания в ремиссию. Эта фаза обычно длится 4–6 недель. В это же время для уничтожения бластных клеток, остающихся в спинномозговой жидкости, может быть назначена сохраняющая терапия центральной нервной системы (ЦНС) (также называемая профилактической терапией ЦНС). В этом случае препараты вводятся в заполненное жидкостью пространство между тонкими слоями ткани, покрывающими спинной мозг (интратекально).
Для лечения используется комбинация химиотерапевтических препаратов. Эти препараты могут включать в себя винкристин, стероиды и пэгаспаргазу или аспарагиназу Erwinia, иногда с препаратом антрациклинового ряда, таким как доксорубицин или даунорубицин. В некоторых протоколах во время индукционной терапии применяют схему лечения, включающую циклофосфамид, цитарабин и 6-меркаптопурин.
2. Фаза консолидации/интенсификации
Целью терапии консолидации/интенсификации является уничтожение любых оставшихся клеток, способных к росту и вызывающих рецидив лейкоза. Эта фаза обычно длится 8-16 недель.
Пациенту назначают различные лекарственные средства, такие как циклофосфамид, цитарабин и или 6-меркаптопурин (6-МП). Также может назначаться метотрексат с терапией под защитой лейковорином или без нее.
3. Фаза стабилизации/продолжения
Целью поддерживающей терапии, последней и наиболее долгой фазы, является уничтожение любых опухолевых клеток, которые могли бы выжить после первых 2 фаз. Фаза стабилизации может продолжаться 2 или 3 года.
Эта фаза может включать в себя применение таких препаратов, как метотрексат, винкристин, стероиды, 6-меркаптопурин (6-МП). Пациентам с высоким риском могут назначаться антрациклиновые препараты, циклофосфамид и цитарабин.
Трансплантация гемопоэтических клеток (также называемая трансплантацией костного мозга или стволовых клеток)
Трансплантация гемопоэтических клеток (также называемая трансплантацией костного мозга или стволовых клеток) может быть рекомендована детям с высоким риском рецидива или с резистентным к лечению ОЛЛ. Иногда врачи оценивают эффективность индукционной химиотерапии, чтобы решить, требуется ли трансплантация.
Пациенты с ОЛЛ, у которых лейкоз является резистентным (не поддающимся лечению) или рецидивирующим, могут быть кандидатами на трансплантацию, если их состояние позволяет и найден подходящий донор.
Таргетная терапия
В таргетной терапии используются лекарственные препараты, которые уничтожают раковые клетки, не нанося вреда окружающим здоровым клеткам. Этот тип терапии может применяться только в том случае, когда рак имеет идентифицируемые маркеры, которые реагируют на доступные препараты таргетной терапии.
Иммунотерапия
Иммунотерапия — это метод лечения рака, при котором для борьбы с опухолью задействуется иммунная система. Иммунотерапия помогает иммунной системе находить опухолевые клетки, чтобы атаковать их, и/или повышает способность иммунной системы реагировать на опухоль.
Около 98% детей с ОЛЛ достигают ремиссии через несколько недель после начала лечения.
Более 90% детей с ОЛЛ могут выздороветь. Пациенты считаются выздоровевшими примерно через 5 лет ремиссии.
Коэффициент выживаемости для пациентов с ОЛЛ в группах низкого риска может составлять более 95%.
Если у пациента резистентная (не дающая ответа на лечение) или рецидивирующая форма ОЛЛ, врачи обсуждают дальнейшие варианты терапии.
Отдаленное последствие — это проблема со здоровьем, возникающая спустя месяцы или годы после диагностирования заболевания или после окончания лечения. Отдаленные последствия могут быть вызваны как самой опухолью, так и ее лечением. Они могут включать в себя физические, психические и социальные проблемы, а также метастазирование.
К отдаленным последствиям относятся:
Текущие исследования проводятся в области разработки более эффективных методов лечения детских опухолей, не дающих ответа на первоначальную терапию, и в области разработки новых методов лечения, направленных на уничтожение раковых клеток без нанесения вреда окружающим здоровым клеткам. Исследователи также уделяют основное внимание разработке методов лечения, которые вызывают меньше отдаленных последствий у пациентов, перенесших онкозаболевания. Эту проблему помогут решить исследования в области отдаленных последствий среди растущего числа пациентов с долгосрочной выживаемостью.
—
Дата изменения: июнь 2018 г.