Qu’est-ce que le sarcome des tissus mous non rhabdomyosarcome ?
Un sarcome des tissus mous non rhabdomyosarcome (STMNR) est une tumeur qui se développe dans les tissus mous du corps. Il existe de nombreux types de ces tumeurs. Ils sont toutefois généralement traités de manière similaire.
Les tumeurs du STMNR représentent environ 4 % de tous les cancers de l’enfant. Elles sont le plus fréquentes chez les adolescents.
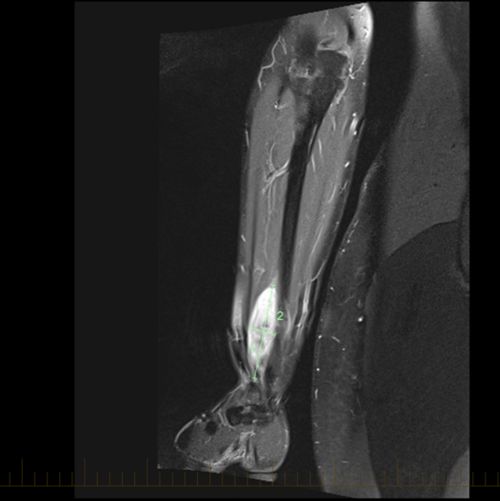
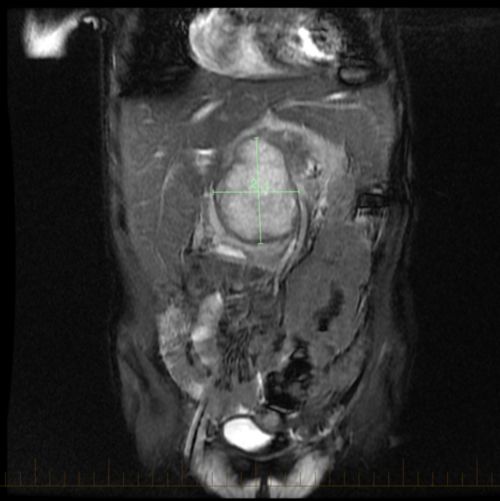
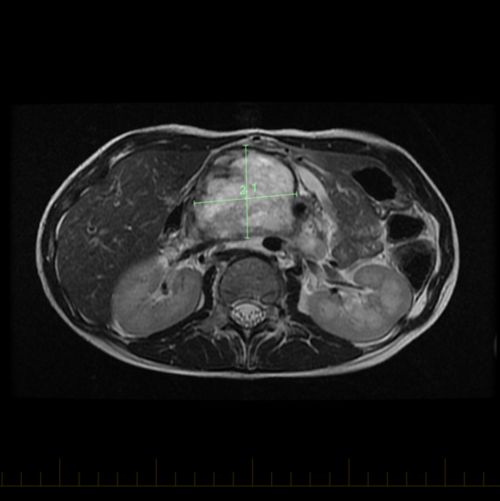
Un STMNR peut se former n’importe où dans le corps. Il se trouve cependant le plus souvent dans les bras ou les jambes. Un STMNR peut également se développer dans la tête et le cou, le thorax, l’abdomen ou le bassin.
Les types du STMNR les plus fréquents chez les enfants incluent :
- Fibrosarcome
- Sarcome synovial
- Tumeurs malignes des gaines nerveuses périphériques
Les autres types de tumeurs du STMNR sont :
- Sarcome à cellules claires
- Sarcome épithélioïde
- Hémangiopéricytome
- Léiomyosarcome
- Liposarcome
- Histiocytome fibreux malin
- Sarcome des cellules non-synoviales
- Sarcome indifférencié
Symptômes du STMNR
Les symptômes du STMNR dépendent de l’emplacement de la tumeur. À un stade précoce, il n’y a souvent aucun autre symptôme qu’une grosseur indolore.
Des problèmes tels que douleurs ou faiblesse peuvent survenir à mesure que la tumeur se développe et fait pression sur d’autres structures.
La maladie à un stade plus avancé peut parfois entraîner des symptômes tels que fièvre, transpiration ou perte de poids.
Facteurs de risque et causes du STMNR
Les tumeurs du STMNR chez les enfants sont le plus souvent observées chez les nourrissons et les adolescents. Ces tumeurs sont légèrement plus fréquentes chez les garçons. Un traitement antérieur par radiothérapie peut également augmenter le risque de STMNR.
Certaines maladies transmises de génération en génération peuvent augmenter le risque de STMNR. Parmi ceux-ci :
- Syndrome de Li-Fraumeni
- Neurofibromatose de type 1
- Polypose adénomateuse familiale
- Syndrome de Werner
- Changements du gène 1 du rétinoblastome
- Changements du gène SMARCB1
- Syndromes de réparation des mésappariements
- Myofibromatose infantile de type 1
Diagnostic du STMNR
Plusieurs types de procédures et de tests sont utilisés pour diagnostiquer un STMNR. Parmi ceux-ci :
- Les antécédents médicaux, un examen physique et des analyses de sang pour en savoir plus sur les symptômes, l’état de santé général, les maladies passées et les facteurs de risque
- Des tests d’imagerie, notamment une IRM ou une tomodensitométrie de la tumeur primitive.
- Une biopsie de la tumeur
- Une tomodensitométrie du thorax pour voir si le cancer s’est propagé aux poumons
- Imagerie du corps entier utilisant des scintigraphies osseuses ou des tomographies par émission de positons pour regarder si le cancer s’est propagé aux os et à d’autres zones du corps
- Imagerie et biopsie des ganglions lymphatiques
Stadification du STMNR
Les sarcomes des tissus mous sont classés par stade. La stadification est basée sur les caractéristiques de la tumeur, notamment :
- Taille
- Si elle s’est propagée
- Grade de la tumeur
Traitement du STMNR
Intervention chirurgicale
L’intervention chirurgicale est utilisée pour retirer un maximum de la masse cancéreuse. Les médecins retirent également une petite quantité de tissu autour de la tumeur et des ganglions lymphatiques voisins pour s’assurer qu’aucune cellule cancéreuse n’est oubliée.
Une maladie à faible risque peut être traitée par intervention chirurgicale uniquement si la tumeur peut être complètement retirée sans cellules cancéreuses restantes.
Radiothérapie
La radiothérapie peut être utilisée pour traiter tout STMNR qui ne peut pas être complètement retiré lors de l’intervention chirurgicale. Dans certains cas, la radiothérapie peut être utilisée avant l’intervention chirurgicale pour faciliter l’ablation de la tumeur.
Chimiothérapie
La chimiothérapie utilise des médicaments puissants pour tuer les cellules cancéreuses ou les empêcher de se développer et de produire de nouvelles cellules cancéreuses. La chimiothérapie ne fonctionne pas bien pour la plupart des patients atteints de STMNR.
Elle est le plus souvent utilisée pour traiter les patients à risque élevé. Ceci inclut les patients dont la maladie s’est propagée ou ceux qui ne peuvent pas être traités par une intervention chirurgicale.
Thérapies ciblées
Les scientifiques étudient des thérapies ciblées pour traiter le STMNR. Ces médicaments agissent sur des cibles spécifiques de cellules cancéreuses pour les empêcher de se développer. Certaines thérapies ciblent spécifiquement certains sous-types de STMNR. Bon nombre de ces traitements sont étudiés dans le cadre d’ essais cliniques.
Pronostic pour le STMNR
Les chances de rétablissement après un STMNR dépendent de plusieurs facteurs :
- Type de tumeur
- Emplacement d’origine de la tumeur
- Grade de la tumeur et apparence des cellules au microscope (histologie) ; le pronostic pour les tumeurs de faible grade est meilleur
- Taille de la tumeur : Les tumeurs plus grandes (supérieures à 5 cm) sont plus difficiles à traiter.
- Profondeur sous-cutanée de la tumeur
- Si le cancer s’est propagé aux ganglions lymphatiques ou à d’autres parties du corps
- Si l’intervention chirurgicale peut complètement retirer la tumeur
- Si la tumeur est nouvelle ou a récidivé
- Si la radiothérapie a été utilisée pour traiter le cancer
Le pronostic des patients présentant une tumeur répondant à certaines conditions est meilleur :
Environ 15 % des patients présentent une maladie qui s’est propagée au moment du diagnostic. Le poumon est l’emplacement le plus courant pour les métastases du STMNR.
Rarement, le STMNR peut se propager aux os ou aux ganglions lymphatiques.
Si le cancer s’est déjà propagé au moment du diagnostic, les chances de survie à long terme sont inférieures à 20 %.
Les STMNR qui récidivent après le traitement sont difficiles à traiter. Les chances de guérison sont faibles. Des essais cliniques pourraient être une option.
Il est important de trouver un équilibre entre qualité de vie et traitement contre le cancer. Parlez à votre équipe soignante des problèmes auxquels s’attendre et de la façon de les gérer.